Рентгеноспектральное исследование и компьютерное моделирование локальной атомной структуры центра связывания иона меди в бета амилоиде
Аннотация
Дата поступления статьи: 30.05.2013Проведено исследование локального окружения иона меди Cu(I) в пептиде бета-амилоида при помощи XANES спектроскопии для нескольких моделей активного центра бета-амилоида. Модели центра связывания были получены методом молекулярной механики и при помощи теории функционала электронной плотности в программе ADF. Теоретический анализ спектров рентгеновского поглощения проводился на основе метода конечных разностей, реализованного в программе FDMNES. В результате исследования получены модели подходящие для описания центра связывания иона меди в бета-амилоиде.
Ключевые слова: бета амилоид, центр связывания, болезнь Альцгеймера, метод конечных разностей, Cu(I)
В настоящее время болезнь Альцгеймера считается неизлечимым заболеванием [1]. В России от нее страдают около полутора миллионов человек, и частота поражения болезнью Альцгеймера будет неуклонно возрастать в связи с общей тенденцией к старению населения [2]. Главную морфологическую особенность болезни Альцгеймера составляют нерастворимые отложения бета-амилоида в ткани головного мозга [3]. Однако современные исследования показали, что бета-амилоид является нормальным белком организма и выполняет важные физиологические функции [4,5]. Не так давно было обнаружено, что в нерастворимых отложениях бета-амилоида - амилоидных бляшках - повышена концентрация меди и при этом ионы меди связаны с белком [6]. Структура центра связывания меди отвечает за основные физико-химические свойства белка и представляет несомненный интерес для понимания биохимических процессов. Установление фундаментальных взаимосвязей структуры центра связывания меди в бета-амилоиде с процессами, протекающими во время образования амилоидных бляшек важно для понимания этиологии этого заболевания и в будущем может способствовать разработке эффективного метода борьбы с болезнью Альцгеймера.
В нашей работе представлено исследование локального окружения иона меди Cu1+ в пептиде бета-амилоида при помощи комбинации методов квантово-химических расчетов и XANES спектроскопии (международный термин - X-ray Absorption Near Edge Structure). Спектроскопия XANES – мощный метод исследования локальной атомной и электронной структуры вещества, чувствительный к ближайшему окружению поглощающего атома и позволяющий исследовать структуру соединений без дальнего порядка в расположении атомов [7]. В частности ранее с помощью рентгеновской спектроскопии поглощения была исследована динамика атомной и электронной структуры материалов водородной энергетики [8] и разработан новый метод для определения параметров 3D наноразмерной атомной и электронной структуры нанокатализаторов [9].
Известно, что при определённых условиях связывание меди с бета-амилоидом более вероятно в линейной конформации [10,11] (рис. 1А). В данной работе были определены расстояния и углы связи для модели центра связывания иона меди Cu1+ в бета-амилоиде с помощью комбинации методов рентгеновской спектроскопии XANES и квантово-химических расчётов. За основу для моделирования была взята простая структура – ион меди, координированный двумя имидазольными кольцами.
Теоретический анализ XANES спектров проводился на основе метода конечных разностей в полном потенциале (программный комплекс FDMNES [12]). Моделирование структуры центра связывания было выполнено при помощи методов молекулярной механики и теории функционала электронной плотности (программный комплекс ADF - Amsterdam Density Functional [13]). Проводилась геометрическая оптимизация локальной структуры путем минимизации полной энергии системы с использованием обменно-корреляционного потенциала в приближении обобщенных градиентов Becke-Perdew и базисным набором DZ (Double Z). Рассматривались модели с нулевым суммарным зарядом.
На основе схемы (рис. 1А) из статьи [10] была построена модель М0 (рис. 1Б). Эта модель является заведомо неточной, так как имидазольные кольца были расположены случайным образом, но с помощью нее можно наглядно показать чувствительность метода к изменению ближайшего окружения иона меди для данной структуры. Далее, методом молекулярной механики была получена модель ММ (рис. 1В). Модель DFT (рис. 1Г) была рассчитана в рамках теории функционала плотности.
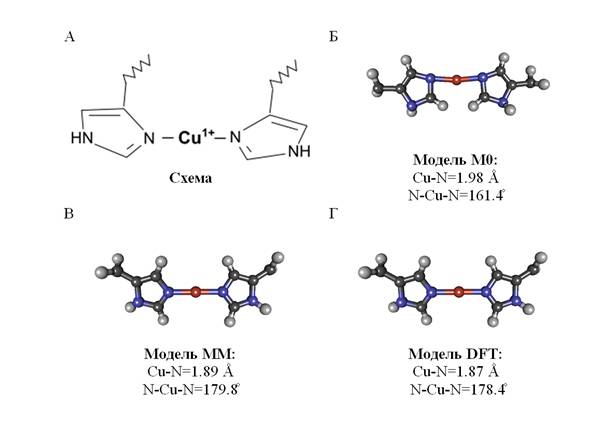
Рис. 1. – А - схематическое изображения центра связывания иона меди с бета-амилоидом, Б - расчетная модель М0, В - расчетная модель ММ, Г - расчетная модель DFT
Полученные модели (ММ и DFT) имеют минимальные различия, в частности разница в длине связи Cu-N равна 0.02 Ǻ, что находится в пределах чувствительности метода рентгеновской спектроскопии. Так для модели ММ длина связи Cu-N=1.89 Ǻ, а угол: N-Cu-N=179.8̊, а для модели DFT - Cu-N=1.87 Ǻ, угол: N-Cu-N=178.4̊.
Для приведённых выше моделей были рассчитаны спектры рентгеновского поглощения за К-краем меди (I). Расчеты проводились для разных радиусов сетки 3.5 Ǻ (в расчет включено 11 атомов), 4.0 Ǻ (11 атомов), 4.5 Ǻ (15 атомов) 5.0 Ǻ (17 атомов), шаг сетки во всех случаях составлял 0.25 Ǻ. На рис. 2 представлено сравнение рассчитанных спектров рентгеновского поглощения для трёх моделей с экспериментальным. Экспериментальный спектр рентгеновского поглощения для жидкого раствора бета-амилоида с ионами одновалентной меди был измерен при комнатной температуре [10]. Следует отметить, что сходимость теоретических спектров для всех моделей наблюдается при радиусе кластера 5.0 Ǻ.
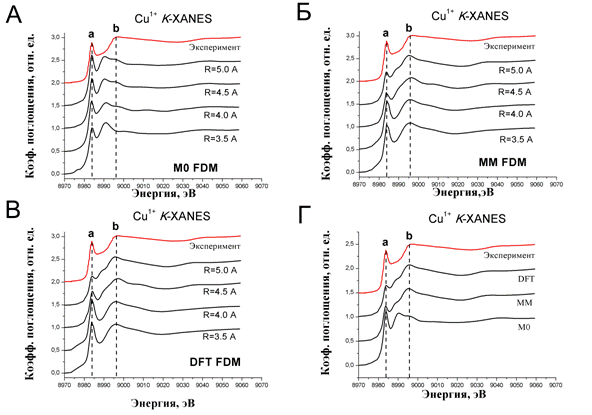
Рис. 2. – Теоретические спектры рентгеновского поглощения: А – для модели М0, Б – для модели ММ, В – для модели DFT, Г – сравнение спектров рентгеновского поглощения для всех рассмотренных моделей
На рис. 2А представлены спектры рентгеновского поглощения для модели М0. Спектры, рассчитанные для модели М0 не показывают хорошего согласия с экспериментом: интенсивность предпика а на рассчитанном спектре завышена, но энергетическое положение соответствует эксперименту. Стоит отметить, что расчёты проводились без самосогласования электронной структуры, поэтому интенсивность предпика а может быть оценена не совсем верно. Более важным является тот факт, что энергетическое положение основного максимума b не соответствует экспериментальному, что означает несоответствие структурных параметров модели М0 исследуемой структуре.
Далее рассматривая спектры рентгеновского поглощения для моделей ММ (рис. 2Б) и DFT (рис.2В), можно видеть, что спектры дают хорошее согласие с экспериментом при размере атомного кластера 5.0 Ǻ. На спектрах, рассчитанных для моделей ММ и DFT, воспроизводится энергетическое положение предпика a, однако эти расчеты так же проводились без самосогласования электронной структуры, и вследствие этого интенсивность особенности а недооценена Энергетическое положение и интенсивность основного максимума b, а также поведение спектра рентгеновского поглощения за основным максимумом соответствует экспериментальному спектру, что позволяет говорить о том, что модельные структуры ММ и DFT адекватно описывают исследуемую структуру.
Теоретический анализ спектров рентгеновского поглощения для центра связывания Cu1+ в пептиде бета-амилоида показал, что спектры, рассчитанные для моделей ММ и DFT (рис. 2Г) дают хорошее согласие с экспериментом, и структуры ММ и DFT подходят для описания центра связывания иона меди Cu (I) в бета-амилоиде.
Расчёты проводились на вычислительных кластерах ЮГИНФО ЮФУ.
Исследование выполнено при поддержке Министерства образования и науки Российской Федерации: соглашения 14.A18.21.1940 и 14.A18.21.1070, стипендия Президента Российской Федерации СП-2373.2013.5.
Литература:
- Болезнь Альцгеймера //Большая иллюстрированная энциклопедия. В 32 томах. Т1. Б 79 А-АМА – М.: АСТ:Астрель. 2010. –499 c.
- Белоусов Ю. Б., Зырянов С. К., Белоусов Д. Ю., Бекетов А. С. // Качественная клиническая практика, Спецвыпуск. 2009. № 28.
- Дэйвис К. Л. Болезнь Альцгеймера: поиск новых способов сохранения функции мозга // Международный Медицинский Журнал. 1999. №9-10.
- Kamal A., Almenar-Queralt A., LeBlanc J. F., Roberts E. A., Goldstein L.S. B. Kinesin-mediated axonal transport of a membrane compartment containing b-secretase and presenilin-1 requires APP // Nature. 2001. – Vol. 414. P. 603-618.
- Prangkio P, Yusko EC, Sept D, Yang J, Mayer M (2012) Multivariate Analyses of Amyloid-Beta Oligomer Populations Indicate a Connection between Pore Formation and Cytotoxicity// PLoS ONE. 2012. - Vol.7(10). P. e47261.
- Kessler H., Bayer T. A., Bach D., Schneider-Axmann T., Supprian T., Herrmann W., Haber M., Multhaup G., Falkai P., Pajonk F.-G. Intake of copper has no effect on cognition in patients with mild Alzheimer’s disease: a pilot phase 2 clinical trial // Journal of Neural Transmission. 2008. Vol. 115. P. 1181-1187.
- Солдатов А. В. От спектроскопии EXAFS к спектроскопии XANES: новые возможности исследования материи // Соросовский образовательный журнал. 1998. №12.
- Бугаев А.Л., Гуда А.А., Дмитриев В.П., Ломаченко К.А., Панкин И.А., Смоленцев Н.Ю., Солдатов М.А., Солдатов А.В. Динамика наноразмерной атомной и электронной структуры материалов водородной энергетики при реалистичных технологических условиях [Электронный ресурс] // «Инженерный вестник Дона», 2012, №4. – Режим доступа:http://www.ivdon.ru/magazine/archive/n4p1y2012/1269 (доступ свободный) - Загл. с экрана. – Яз. рус.
- Смирнова Ю.О., Положенцев О.Е., Леонтьева Д.В., Чайников А.П., Сучкова С.А., Гуда А.А., Ломаченко К.А., Смоленцев Н.Ю., Подковырина Ю.С., Солдатов М.А., Кравцова А.Н., Солдатов А.В. Разработка нового комплексного метода определения параметров 3D наноразмерной атомной и электронной структуры материалов на основе методик XAFS, XRD и Raman [Электронный ресурс] // «Инженерный вестник Дона», 2012, №4. – Режим доступа: http://www.ivdon.ru/magazine/archive/n4p1y2012/1268 (доступ свободный) - Загл. с экрана. – Яз. рус.
- Hureau C., Balland V., Coppel Y., Solari P. L., Fonda E., Faller P. Importance of dynamical processes in the coordination chemistry and redox conversion of copper amyloid-b complexes // JBIC Journal of Biological Inorganic Chemistry. 2009. - Vol. 14. P. 995.
- Shearer J., Szalai V. A. The amyloid-β peptide of Alzheimer's disease binds CuI in a linear bis-His coordination environment: Insight into a possible neuroprotective mechanism for the amyloid-β peptide // J Am Chem Soc. 2008. – Vol. 130(52). P. 17826–17835.
- Joly Y. X-ray absorption near edge structure calculations beyond the muffin-tin approximation // Phys. Rev. B. 2001. – Vol. 63. 125120.
- te Velde G., Bickelhaupt F.M., van Gisbergen S.J.A., Fonseca Guerra C., Baerends E.J., Snijders J.G., Ziegler T. // Chemistry with ADF, Journal of Computational Chemistry. 2001. – Vol. 22. P. 931.